2020年,国内干细胞政策汇总
发布时间:
2021-01-20
来源:
2020年,国内干细胞政策汇总
伴随干细胞领域研究的稳健推进,干细胞技术在治疗疾病、器官移植、组织修复等领域发挥出了巨大的应用潜力。我国政府也出台了相关政策法规,大力推进干细胞产业化发展。
国家层面
1、2020年1月 科技部等部门发布《加强“从0到1”基础研究工作方案》
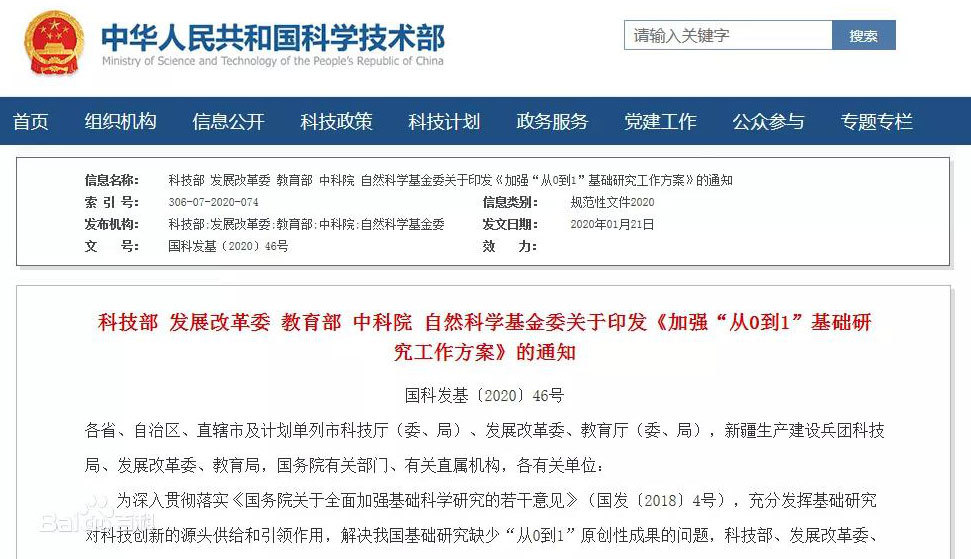
科技部、发展改革委、教育部、中科院、自然科学基金委发布关于印发《加强“从0到1”基础研究工作方案》的通知,在重大专项和重点研发计划中突出支持基础研究重点领域原创方向,持续支持量子科学、脑科学、纳米科学、干细胞、合成生物学、发育编程、全球变化及应对、蛋白质机器、大科学装置前沿研究等重点领域,针对重点领域、重大工程等国家重大战略需求中的关键数学问题,加强应用数学和交叉研究,加强引力波、极端制造、催化科学、物态调控、地球系统科学、人类疾病动物模型等领域部署,抢占前沿科学研究制高点。
2、2020年3月 科技部《“干细胞及转化研究”试点专项2020年项目申报指南》
3月31日,科技部发布了《科技部关于发布国家重点研发计划“干细胞及转化研究”等重点专项2020年度项目申报指南的通知》。2020年,国拨总经费 2.40亿元。
3、2020年7月 CDE《免疫细胞治疗产品临床试验技术指导原则(征求意见稿)》
2020年7月6日,国家药品监督管理局药品审评中心发布《免疫细胞治疗产品临床试验技术指导原则(征求意见稿)》。

本指导原则的内容适用于按照药品管理相关法规进行研发和注册申报的细胞免疫治疗产品,旨在为该类产品开展临床试验的总体规划、设计、实施和试验数据分析等方面提供必要的技术指导,以减少受试者参加临床试验的风险,并规范对细胞免疫治疗产品的安全性和有效性的评价方法。
4、2020年8月 CDE《人源性干细胞及其衍生细胞治疗产品临床试验技术指导原则(征求意见稿)》

8月4日,国家药品监督管理局药品审评中心组织起草了《人源性干细胞及其衍生细胞治疗产品临床试验技术指导原则(征求意见稿)》,以期为药品研发注册申请人及开展药物临床试验的研究者提供更具针对性的建议和指南。
5、2020年9月 科技部等部门《关于推动我国细胞产业高质量发展的提案》
国家卫健委《关于推动我国细胞产业高质量发展的提案》的答复函中明确将根据干细胞临床研究项目实施进展情况,基于临床研究结果,前瞻性研究提出临床应用转化的有关政策建议。同时积极落实临床研究项目备案绿色通道制度,强化对干细胞临床研究机构开展干细胞临床研究项目的辅导和指导,共同推进细胞产业发展。
6、2020年9月 国务院《关于印发北京、湖南、安徽自由贸易试验区总体方案及浙江自由贸易试验区扩展区域方案的通知》

国务院发布《关于印发北京、湖南、安徽自由贸易试验区总体方案及浙江自由贸易试验区扩展区域方案的通知》。明确自贸区内可开展跨境远程医疗等临床医学研究,区内医疗机构可根据自身技术能力,按照有关规定开展干细胞临床前沿医疗技术研究项目。支持开展免疫细胞、干细胞等临床前沿医疗技术研究项目。
天津地区
7、天津 2020年5月《关于2020年“滨海新区细胞产业技术创新行动方案”工作要点通知》

争取干细胞、免疫细胞治疗等先进生物治疗技术的临床应用试点。滨海新区积极努力争取市卫健委、市科技局、市市场局等多部门支持,共同研究制定支持生物医药产业发展的有关优惠政策。
Copyright ⓒ TINGO Regenerative Medicine 地址:天津滨海高新区康泰大道59号


